Introducción
Las celdas electroquímicas son dispositivos que convierten la energía química en energía eléctrica o viceversa. Estas celdas funcionan mediante reacciones redox, donde la transferencia de electrones entre diferentes especies químicas genera una corriente eléctrica. Las celdas electroquímicas son esenciales en una amplia gama de aplicaciones, desde la producción de electricidad en baterías hasta la protección contra la corrosión en metales.
Una de las celdas electroquímicas más conocidas es la celda de Daniell, que lleva el nombre del químico británico John Frederic Daniell, quien la inventó en 1836. La celda de Daniell es un ejemplo clásico de una celda galvánica, también conocida como celda voltaica, que genera electricidad a partir de una reacción química espontánea.
Principios de las celdas electroquímicas
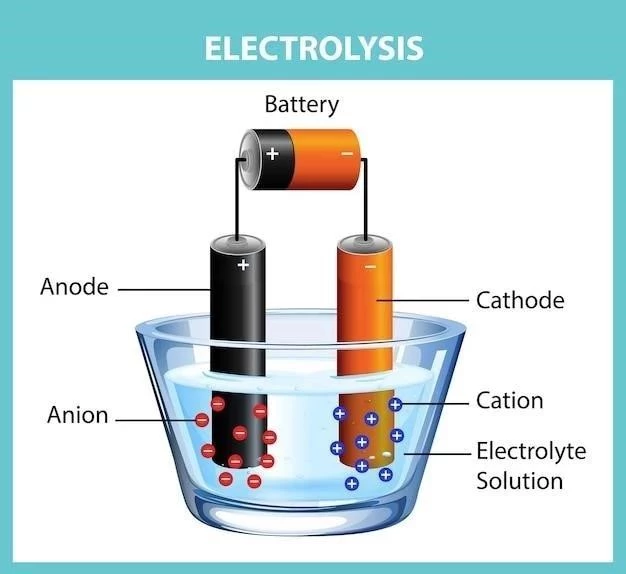
Las celdas electroquímicas se basan en el principio de la electroquímica, que estudia la relación entre las reacciones químicas y la electricidad. En una celda electroquímica, dos electrodos, hechos de diferentes metales o materiales conductores, se sumergen en un electrolito, una solución iónica que permite la conductividad eléctrica. Los electrodos actúan como sitios donde se producen las reacciones redox, mientras que el electrolito facilita el movimiento de iones para completar el circuito eléctrico.
Reacciones redox en celdas electroquímicas
Las reacciones redox son reacciones químicas que involucran la transferencia de electrones. En una celda electroquímica, la reacción redox se divide en dos semirreacciones⁚ una reacción de oxidación en el ánodo y una reacción de reducción en el cátodo.
Oxidación en el ánodo
En el ánodo, se produce la oxidación, donde una especie química pierde electrones. Esta pérdida de electrones genera una corriente eléctrica que fluye hacia el circuito externo. La ecuación general para la oxidación se puede escribir como⁚
$A ightarrow A^{n+} + ne^-$
donde $A$ es el átomo o molécula que se oxida, $A^{n+}$ es el ion resultante y $n$ es el número de electrones transferidos.
Reducción en el cátodo
En el cátodo, se produce la reducción, donde una especie química gana electrones. Estos electrones provienen del ánodo a través del circuito externo. La ecuación general para la reducción se puede escribir como⁚
$B^{m+} + me^- ightarrow B$
donde $B^{m+}$ es el ion que se reduce, $B$ es la especie química resultante y $m$ es el número de electrones transferidos.
Potencial de celda y fuerza electromotriz (FEM)
La diferencia de potencial eléctrico entre el ánodo y el cátodo se conoce como potencial de celda o fuerza electromotriz (FEM). La FEM es una medida de la tendencia de la celda a generar corriente eléctrica. El potencial de celda se puede calcular utilizando la ecuación de Nernst, que relaciona el potencial de celda con las concentraciones de las especies químicas involucradas y la temperatura.
$E_{celda} = E°_{celda} ─ rac{RT}{nF} lnQ$
donde⁚
- $E_{celda}$ es el potencial de celda.
- $E°_{celda}$ es el potencial estándar de celda.
- $R$ es la constante de los gases ideales.
- $T$ es la temperatura en Kelvin.
- $n$ es el número de electrones transferidos.
- $F$ es la constante de Faraday.
- $Q$ es el cociente de reacción.
Ley de Faraday
La ley de Faraday establece que la cantidad de sustancia depositada o liberada en un electrodo es proporcional a la cantidad de electricidad que pasa a través de la celda. La ley de Faraday se puede expresar mediante la siguiente ecuación⁚
$m = rac{Q}{nF}M$
donde⁚
- $m$ es la masa de la sustancia depositada o liberada.
- $Q$ es la cantidad de electricidad en culombios.
- $n$ es el número de electrones transferidos.
- $F$ es la constante de Faraday.
- $M$ es la masa molar de la sustancia.
La celda de Daniell
La celda de Daniell es una celda galvánica que consiste en un electrodo de cobre sumergido en una solución de sulfato de cobre (CuSO4) y un electrodo de zinc sumergido en una solución de sulfato de zinc (ZnSO4). Los dos electrodos están conectados por un puente salino, que permite el flujo de iones para completar el circuito eléctrico.
Reacciones en la celda de Daniell
En la celda de Daniell, se produce la siguiente reacción redox⁚
$Zn(s) + Cu^{2+}(ac) ightarrow Zn^{2+}(ac) + Cu(s)$
En el ánodo, el zinc metálico se oxida, perdiendo dos electrones para formar iones zinc (Zn2+)⁚
$Zn(s) ightarrow Zn^{2+}(ac) + 2e^-$
En el cátodo, los iones cobre (Cu2+) se reducen, ganando dos electrones para formar cobre metálico⁚
$Cu^{2+}(ac) + 2e^- ightarrow Cu(s)$
Potencial de celda de Daniell
El potencial estándar de celda para la celda de Daniell es de 1.10 V. Esto significa que la celda de Daniell puede generar una corriente eléctrica de 1.10 V bajo condiciones estándar (25 °C y 1 atm). El potencial de celda se puede calcular utilizando la ecuación de Nernst, teniendo en cuenta las concentraciones de los iones zinc y cobre.
Aplicaciones de las celdas electroquímicas
Las celdas electroquímicas tienen una amplia gama de aplicaciones, incluyendo⁚
- Baterías⁚ Las baterías son dispositivos que almacenan energía química y la liberan como energía eléctrica. Las baterías se utilizan en una amplia gama de dispositivos, desde teléfonos móviles hasta automóviles eléctricos.
- Celdas de combustible⁚ Las celdas de combustible convierten la energía química de los combustibles, como el hidrógeno, en energía eléctrica. Las celdas de combustible son una fuente de energía limpia y eficiente.
- Electroplateado⁚ El electroplateado es un proceso que utiliza la electricidad para depositar una capa delgada de metal sobre otro material. El electroplateado se utiliza para mejorar la resistencia a la corrosión, la conductividad eléctrica o el aspecto estético de los metales.
- Protección contra la corrosión⁚ Las celdas electroquímicas se pueden utilizar para proteger los metales de la corrosión. La protección catódica es un método que utiliza un ánodo sacrificial para proteger un metal de la corrosión.
- Electroquímica analítica⁚ Las celdas electroquímicas se utilizan en métodos analíticos para determinar la concentración de sustancias químicas en soluciones.
Conclusión
Las celdas electroquímicas son dispositivos esenciales que convierten la energía química en energía eléctrica o viceversa. La celda de Daniell es un ejemplo clásico de una celda galvánica que utiliza una reacción redox espontánea para generar electricidad. Las celdas electroquímicas tienen una amplia gama de aplicaciones, desde la producción de electricidad en baterías hasta la protección contra la corrosión en metales.
El estudio de las celdas electroquímicas es fundamental para comprender la electroquímica y sus aplicaciones en la vida cotidiana. Las celdas electroquímicas desempeñan un papel vital en la sociedad moderna, proporcionando energía limpia y eficiente, protegiendo los metales de la corrosión y permitiendo la realización de análisis químicos precisos.






La redacción del artículo es fluida y precisa, utilizando un lenguaje técnico adecuado sin resultar demasiado complejo. La información se presenta de forma concisa y fácil de entender.
El artículo podría ampliar la información sobre los diferentes tipos de celdas electroquímicas, como las celdas de combustible y las baterías de flujo. También sería interesante mencionar las aplicaciones más recientes y las tendencias en este campo.
El artículo es una buena introducción al tema de las celdas electroquímicas, pero podría beneficiarse de una mayor profundidad en la explicación de los conceptos. Por ejemplo, se podría mencionar la importancia de la termodinámica en el funcionamiento de las celdas.
En general, el artículo es un buen recurso para comprender los conceptos básicos de las celdas electroquímicas. La inclusión de referencias bibliográficas adicionales sería un complemento valioso para el lector interesado en profundizar en el tema.
El artículo ofrece una introducción clara y concisa a las celdas electroquímicas, cubriendo conceptos fundamentales como las reacciones redox y los componentes de una celda. La explicación de los principios básicos es accesible para un público general, lo que lo convierte en un buen punto de partida para comprender este tema.
El artículo destaca la importancia de las celdas electroquímicas en diversas aplicaciones, desde la producción de energía hasta la protección contra la corrosión. La inclusión de ejemplos concretos como la celda de Daniell enriquece la comprensión del lector.
La estructura del artículo es lógica y facilita la comprensión de los conceptos. La utilización de ecuaciones químicas y diagramas ilustra las reacciones redox de manera clara y precisa.
El artículo es informativo y bien escrito, pero podría incluir más ejemplos prácticos de aplicaciones de las celdas electroquímicas en la vida cotidiana. Esto ayudaría a conectar los conceptos con la realidad del lector.