En el vasto y complejo mundo de la química, uno de los conceptos fundamentales que sustentan la formación de moléculas y la estructura de la materia es el enlace químico. Los enlaces químicos, que son las fuerzas que mantienen unidos a los átomos, son responsables de la diversidad y las propiedades únicas de las sustancias que encontramos a nuestro alrededor. Entre los diferentes tipos de enlaces químicos, los enlaces iónicos destacan como un tipo de interacción electrostática que da lugar a la formación de compuestos iónicos, esenciales para la vida y la tecnología.
Introducción a los Enlaces Iónicos
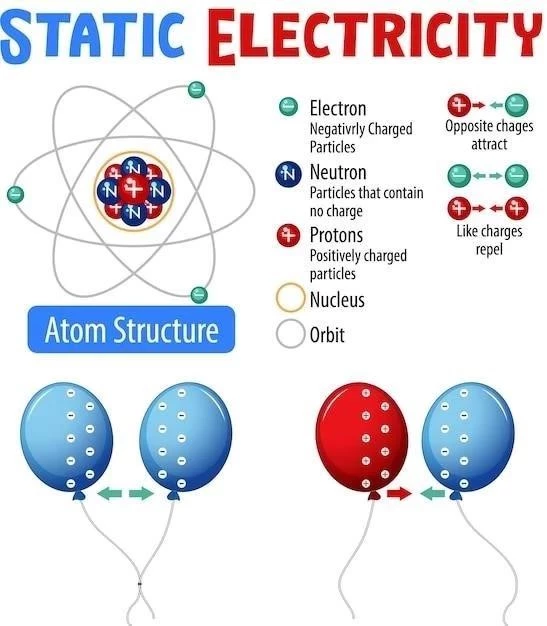
Los enlaces iónicos son un tipo de enlace químico que se forma entre átomos con una gran diferencia de electronegatividad, lo que significa que un átomo tiene una mayor atracción por los electrones que el otro. Esta diferencia de electronegatividad conduce a la transferencia de uno o más electrones de un átomo a otro, formando iones con cargas opuestas que se atraen electrostáticamente. El resultado es la formación de un compuesto iónico, donde los iones se mantienen unidos en una estructura tridimensional conocida como red cristalina.
El Proceso de Formación de Iones
La formación de iones es el proceso fundamental que da lugar a los enlaces iónicos. Este proceso se puede describir de la siguiente manera⁚
1. Diferencia de Electronegatividad
La electronegatividad es una medida de la capacidad de un átomo para atraer electrones hacia sí mismo cuando forma un enlace químico. Los átomos de los elementos que se encuentran en el lado derecho de la tabla periódica, como los halógenos (F, Cl, Br, I), tienen una alta electronegatividad, mientras que los átomos de los elementos del lado izquierdo, como los metales alcalinos (Li, Na, K), tienen una baja electronegatividad. Cuando un átomo con alta electronegatividad se une a un átomo con baja electronegatividad, existe una gran diferencia de electronegatividad.
2. Transferencia de Electrones
Debido a la gran diferencia de electronegatividad, el átomo con mayor electronegatividad tiene una fuerte atracción por los electrones del átomo con menor electronegatividad. Esta atracción es tan fuerte que el átomo más electronegativo “roba” uno o más electrones del átomo menos electronegativo. Este proceso de transferencia de electrones conduce a la formación de iones.
3. Formación de Cationes y Aniones
Cuando un átomo pierde uno o más electrones, adquiere una carga positiva y se convierte en un catión. Por ejemplo, el sodio (Na) tiene un electrón de valencia en su capa más externa. Cuando pierde este electrón, se convierte en el catión sodio (Na+), con una carga positiva.
Por otro lado, cuando un átomo gana uno o más electrones, adquiere una carga negativa y se convierte en un anión. Por ejemplo, el cloro (Cl) tiene siete electrones de valencia en su capa más externa. Cuando gana un electrón, se convierte en el anión cloruro (Cl-), con una carga negativa.
Atracción Electrostática y Formación de Compuestos Iónicos
Una vez que se forman los cationes y aniones, la atracción electrostática entre sus cargas opuestas los mantiene unidos. Esta atracción electrostática es la fuerza que define el enlace iónico. Los cationes y aniones se atraen mutuamente y se organizan en una estructura tridimensional ordenada llamada red cristalina. En esta estructura, los iones se alternan en una disposición regular, maximizando la atracción electrostática y minimizando la repulsión entre iones con la misma carga.
Propiedades de los Compuestos Iónicos
Los compuestos iónicos exhiben una serie de propiedades únicas que se derivan de la naturaleza de los enlaces iónicos y la estructura de la red cristalina⁚
1. Alta Temperatura de Fusión y Ebullición
Las fuertes fuerzas electrostáticas que mantienen unidos a los iones en la red cristalina requieren una gran cantidad de energía para romper estos enlaces. Por lo tanto, los compuestos iónicos tienen altas temperaturas de fusión y ebullición. Por ejemplo, el cloruro de sodio (NaCl) tiene un punto de fusión de 801°C y un punto de ebullición de 1413°C.
2. Dureza
Los compuestos iónicos son generalmente duros debido a la rigidez de la red cristalina. La fuerza de las atracciones electrostáticas entre los iones hace que la red sea resistente a la deformación.
3. Fragilidad
Aunque los compuestos iónicos son duros, también son frágiles. Cuando se aplica una fuerza externa a un cristal iónico, los iones pueden deslizarse uno sobre otro, lo que lleva a una ruptura en la red cristalina. Esto se debe a que la fuerza aplicada puede desplazar los iones, provocando una repulsión entre iones del mismo signo, lo que debilita la estructura y conduce a la fractura.
4. Conductividad Eléctrica
Los compuestos iónicos sólidos no conducen la electricidad porque los iones están fijos en la red cristalina. Sin embargo, cuando se funden o se disuelven en agua, los iones se liberan y pueden moverse libremente, permitiendo la conducción de la electricidad. Esto se debe a que la energía térmica o la disolución en agua rompe la estructura cristalina, liberando los iones para que puedan transportar la carga eléctrica.
5. Solubilidad
La solubilidad de los compuestos iónicos en agua depende de la fuerza relativa de las atracciones entre los iones y las moléculas de agua. Si las atracciones entre los iones y las moléculas de agua son más fuertes que las atracciones entre los iones en la red cristalina, el compuesto iónico se disolverá en agua. Por ejemplo, el cloruro de sodio (NaCl) es soluble en agua porque las atracciones entre los iones sodio (Na+) y los iones cloruro (Cl-) y las moléculas de agua son más fuertes que las atracciones entre los iones en la red cristalina.
Ejemplos de Compuestos Iónicos
Los compuestos iónicos son abundantes en la naturaleza y se utilizan ampliamente en diversas aplicaciones. Algunos ejemplos comunes incluyen⁚
- Cloruro de sodio (NaCl)⁚ La sal de mesa, utilizada como condimento y conservante de alimentos;
- Cloruro de calcio (CaCl2)⁚ Utilizado como agente de descongelación en carreteras y como deshidratante.
- Carbonato de calcio (CaCO3)⁚ Se encuentra en la piedra caliza, el mármol y las conchas de los mariscos.
- Hidróxido de sodio (NaOH)⁚ Un álcali fuerte utilizado en la fabricación de jabón y papel.
- Sulfato de cobre (CuSO4)⁚ Utilizado como fungicida y en la producción de pigmentos.
Importancia de los Enlaces Iónicos
Los enlaces iónicos juegan un papel crucial en muchos aspectos de la química, la biología y la geología. Algunos de los aspectos más importantes incluyen⁚
- Formación de minerales⁚ Muchos minerales de la corteza terrestre están formados por compuestos iónicos, como la halita (NaCl), la calcita (CaCO3) y la fluorita (CaF2).
- Funciones biológicas⁚ Los iones desempeñan un papel fundamental en las reacciones químicas que sustentan la vida. Por ejemplo, los iones sodio (Na+) y potasio (K+) son esenciales para la transmisión de impulsos nerviosos y la contracción muscular.
- Aplicaciones tecnológicas⁚ Los compuestos iónicos se utilizan en una amplia gama de aplicaciones tecnológicas, como la producción de baterías, la fabricación de materiales cerámicos y la síntesis de nuevos compuestos.
Conclusión
Los enlaces iónicos son un tipo de enlace químico fundamental que se forma entre átomos con una gran diferencia de electronegatividad. La formación de iones, la atracción electrostática y la estructura de la red cristalina son características esenciales de los compuestos iónicos. Estos compuestos exhiben propiedades únicas, como altas temperaturas de fusión y ebullición, dureza, fragilidad, conductividad eléctrica y solubilidad, que los hacen importantes en diversas áreas de la química, la biología y la tecnología.
El estudio de los enlaces iónicos es esencial para comprender la estructura, las propiedades y las reacciones de una amplia gama de sustancias. A medida que profundizamos en la comprensión de este tipo de enlace, continuamos descubriendo nuevas aplicaciones y mejorando nuestra comprensión del mundo que nos rodea.






El artículo ofrece una introducción sólida a los enlaces iónicos, explicando claramente los conceptos clave de electronegatividad y transferencia de electrones. La inclusión de ejemplos como el cloruro de sodio (NaCl) es útil para ilustrar el proceso de formación de iones. Sin embargo, se podría ampliar la sección sobre las propiedades de los compuestos iónicos, incluyendo información sobre su estructura cristalina, su conductividad eléctrica y su solubilidad en agua. Además, sería interesante mencionar la importancia de los enlaces iónicos en la química de los materiales, como la formación de cerámicas y cristales.
El artículo presenta una introducción clara y concisa al enlace iónico, explicando los conceptos clave de electronegatividad y transferencia de electrones. La inclusión de ejemplos como el cloruro de sodio (NaCl) es útil para ilustrar el proceso de formación de iones. Sin embargo, se podría ampliar la sección sobre las propiedades de los compuestos iónicos, incluyendo información sobre su estructura cristalina, su conductividad eléctrica y su solubilidad en agua. Además, sería interesante mencionar la importancia de los enlaces iónicos en la química de los materiales, como la formación de cerámicas y cristales.
El artículo ofrece una descripción precisa y concisa del enlace iónico, destacando la importancia de la diferencia de electronegatividad en la formación de iones. La explicación del proceso de formación de iones es clara y fácil de entender. Se podría mejorar la sección sobre las propiedades de los compuestos iónicos, incluyendo una discusión más detallada sobre su estructura cristalina, su alta temperatura de fusión y ebullición, y su solubilidad en agua. Además, sería útil mencionar la importancia de los enlaces iónicos en la química de los materiales, como la formación de metales y aleaciones.
El artículo ofrece una introducción clara y concisa a los enlaces iónicos. La explicación del proceso de formación de iones, incluyendo la diferencia de electronegatividad y la transferencia de electrones, es fácil de entender y está bien ilustrada. La mención de ejemplos concretos, como el cloruro de sodio (NaCl), ayuda a comprender mejor el concepto. Sin embargo, sería beneficioso incluir una sección dedicada a las propiedades de los compuestos iónicos, como su alta temperatura de fusión y ebullición, su solubilidad en agua y su conductividad eléctrica. Además, se podría mencionar brevemente la importancia de los enlaces iónicos en la química orgánica e inorgánica.
El artículo presenta una descripción precisa y concisa del enlace iónico, destacando la importancia de la diferencia de electronegatividad en la formación de iones. La explicación del proceso de formación de iones es clara y fácil de entender. Se podría mejorar la sección sobre las propiedades de los compuestos iónicos, incluyendo una discusión más detallada sobre su estructura cristalina, su alta temperatura de fusión y ebullición, y su solubilidad en agua. Además, sería útil mencionar la importancia de los enlaces iónicos en la química de los materiales, como la formación de metales y aleaciones.
El artículo proporciona una introducción completa al enlace iónico, explicando con precisión los conceptos de electronegatividad y transferencia de electrones. La inclusión de ejemplos concretos, como el fluoruro de sodio (NaF), facilita la comprensión del tema. Sin embargo, sería beneficioso ampliar la sección sobre las propiedades de los compuestos iónicos, incluyendo información sobre su fragilidad, su conductividad eléctrica y su solubilidad en agua. Además, se podría mencionar la importancia de los enlaces iónicos en la química de los materiales, como la formación de cerámicas y cristales.
El artículo presenta un análisis exhaustivo del enlace iónico, abordando aspectos clave como la diferencia de electronegatividad y la formación de iones. La estructura del texto es clara y facilita la comprensión del tema. Sin embargo, la sección dedicada a las propiedades de los compuestos iónicos podría ser más detallada. Se podría mencionar, por ejemplo, la fragilidad de los compuestos iónicos, su capacidad para disolverse en agua y su conductividad eléctrica en estado fundido o en solución. Además, sería interesante incluir una breve discusión sobre la importancia de los enlaces iónicos en la formación de minerales y en la química de los seres vivos.
El artículo ofrece una descripción clara y concisa del enlace iónico, destacando la importancia de la diferencia de electronegatividad en la formación de iones. La explicación del proceso de formación de iones es fácil de entender y está bien ilustrada. Se podría mejorar la sección sobre las propiedades de los compuestos iónicos, incluyendo una discusión más detallada sobre su estructura cristalina, su alta temperatura de fusión y ebullición, y su solubilidad en agua. Además, sería interesante mencionar la importancia de los enlaces iónicos en la química de los materiales, como la formación de metales y aleaciones.